罕見病用藥是國家藥監(jiān)局藥品注冊與監(jiān)管工作會議中每年都會被“點名“的領域,因其急需性,更因其難能可貴。據統(tǒng)計,截至6月30日共約有50款新藥首次獲得中國國家藥監(jiān)局(NMPA)批準上市,約有30多款新藥在中國迎來了新適應癥。本篇內容以“看中國”之名帶您速覽其中罕見病藥物,包括首次批準上市的7款及3款成功擴大適應癥,為中國罕見病患者擴充藥物治療之希望。
(一)首次獲批上市的罕見病藥物
鹽酸奧扎莫德膠囊

百時美施貴寶旗下新型選擇性鞘氨醇1-磷酸(S1P)受體調節(jié)劑熱珀西亞(鹽酸奧扎莫德膠囊)國內獲批,用于治療成人復發(fā)型多發(fā)性硬化,包括臨床孤立綜合征、復發(fā)-緩解型多發(fā)性硬化和活動性繼發(fā)進展型多發(fā)性硬化。企業(yè)稱該藥物是在中國自身免疫疾病領域首個獲批的創(chuàng)新療法,有望為中國多發(fā)性硬化患者帶來“軀體+認知”雙重保護治療新方案。療效和安全性證據來自SUNBEAM(12個月)和RADIANCE(B部分,24個月)兩項大型陽性藥物對照III期研究結果,顯示與干擾素β-1a相比,熱珀西亞可帶來顯著臨床獲益,包括年復發(fā)率(ARR)的顯著降低,持續(xù)治療12個月時降低48%;持續(xù)治療24個月,降低38%;MRI病灶數(shù)減少、腦容量丟失減少及認知功能保護。
尼替西農膠囊

瑞典蘇庇醫(yī)藥(SOBI)開發(fā)的尼替西農是國際上治療1型酪氨酸血癥(HT-1)的首選藥物,今年在國內獲批了口服混懸液和膠囊兩個劑型,用于治療成人和兒科患者的1型遺傳性酪氨酸血癥。尼替西農是一種4-羥苯丙酮酸雙氧酶競爭性抑制劑,該酶在酪氨酸分解代謝途徑中可上調延胡索酰乙酰乙酸酶(FAH)。通過抑制1型酪氨酸血癥患者酪氨酸的正常代謝,該藥可預防代謝中間體馬來酰乙酰乙酸鹽和延胡索酰乙酰乙酸鹽的累積。在1型酪氨酸血癥患者中,這些代謝中間體會轉化為毒性代謝物,造成肝腎毒性。療效對比數(shù)據顯示,2個月以下患兒單用飲食限制方法治療的HT-1患者,2年和4年的存活率均為29%;而增加尼替西農藥物治療后,2年和4年存活率均提高至88%。
西羅莫司凝膠


北京希而歐生物醫(yī)藥是一家中日合資的國際性CRO公司,引進西羅莫司凝膠(商品名:纖洛麗)在國內獲批上市,用于治療6歲及以上兒童和成人患者的結節(jié)性硬化癥相關面部血管纖維瘤。西羅莫司一種大環(huán)內酯抗生素類免疫抑制劑,堪稱藥物中的“多面手”,除可用于器官移植抗排斥反應領域,還可應用在抗衰老、治療腦型瘧疾等治療領域。過去在國內獲批上市均為口服劑型,即片劑、膠囊劑、口服溶液。2022年美國FDA已批準Nobelpharma株式會社的HYFTOR(西羅莫司外用凝膠)0.2%,這是首個外用治療與結節(jié)性硬化癥(TSC)相關成人和6歲以上兒童面部血管纖維瘤的藥物。凝膠的應用應限于血管纖維瘤的受累區(qū)域,應用部位不應被堵塞。
醋酸格拉替雷注射液

醋酸格拉替雷(Glatiramer acetate)是梯瓦制藥(Teva)的老牌多發(fā)性硬化(MS)藥物,于1996年獲得FDA批轉上市。國內藥物的中文商標為固派松,此次國內獲批用于治療復發(fā)型MS成人患者,包括臨床孤立綜合征、復發(fā)緩解型多發(fā)性硬化和活動性繼發(fā)進展型多發(fā)性硬化。獲批規(guī)格(20mg/ml和40mg/ml)均獲得美國FDA批準,其中,40mg/ml降低了每周給藥頻次,提高了患者依從性和便利性。醋酸格拉替雷是由四個氨基酸組成的多肽隨機混合成的醋酸鹽。它的作用機制可能包括,有利地改變促炎反應和調節(jié)細胞分裂素之間的平衡,在一定程度上降低復發(fā)率和疾病的嚴重程度,被認為IFN-β的替代藥物。近30年的臨床研究數(shù)據證實,醋酸格拉替雷可顯著降低復發(fā)率和疾病活動性,改善患者殘疾進展和腦萎縮,降低臨床孤立綜合征轉歸為多發(fā)性硬化的風險,同時還可改善疲勞、認知功能和痙攣等癥狀,并具有長期安全性良好,無明顯時間依賴性的不良反應,非特殊情況無須監(jiān)測。
艾加莫德α注射液


艾加莫德α注射液(衛(wèi)偉迦)由再鼎醫(yī)藥申報,是國內首個且目前唯一NMPA批準的FcRn拮抗劑,它與常規(guī)治療藥物聯(lián)合,獲批用于治療乙酰膽堿受體(AChR)抗體陽性的成人全身型重癥肌無力(gMG)患者。其在美國、歐盟和中國獲批用于AChR抗體陽性的成人gMG治療,在日本獲批用于治療對類固醇或非類固醇免疫抑制療法(ISTs)沒有充分應答的成人gMG患者。在重癥肌無力的治療上,艾加莫德在ADAPT研究的全球三期臨床研究中, 達到了其主要終點,證實了與安慰劑相比,在接受艾加莫德治療后,顯著更多的AChR抗體陽性的gMG患者是重癥肌無力日常活動評分(MG-ADL)應答者(68%對比30%;p<0.0001)。應答者定義為在第一個治療周期內MG-ADL評分連續(xù)4周或以上至少改善2分。
氯馬昔巴特口服溶液

氯馬昔巴特(Maralixibat)口服溶液是一種幾乎不被吸收的回腸膽汁酸轉運蛋白(IBAT)抑制劑,阻斷膽汁酸腸肝回圈,降低肝內和血清中的膽汁酸水平,減少由此介導的肝臟損傷,緩解膽汁淤積瘙癢(極度瘙癢)。此次國內獲批的適應癥為,1歲及以上Alagille綜合征(阿拉杰里綜合征)患者的膽汁淤積性瘙癢。Maralixibat口服溶液由Mirum制藥公司研發(fā),2021年9月首次由美國FDA批準,并于2023年3月FDA批準擴大了Maralixibat口服溶液治療年齡從一歲減至三月齡。這是美國FDA批準的首款用于治療3個月及以上阿拉杰里綜合征綜合征患者的膽汁淤積性瘙癢藥物。2021年,北海康成與Mirum公司宣布簽訂許可協(xié)議,從而獲得在大中華區(qū)開發(fā)和商業(yè)氯馬昔巴特口服溶液針對阿拉杰里綜合征綜合征等適應癥的獨家授權,使用的商品名為“邁芮倍”。
苯丁酸甘油酯


Immedica Pharma公司研發(fā)的口服用苯丁酸甘油酯(瑞維安)由香港維健醫(yī)藥集團引進,國內獲批,作為不能通過限制蛋白質的攝入和/或單純補充氨基酸控制的尿素循環(huán)障礙(UCDs)患者的長期治療,包括氨甲酰磷酸合成酶I缺乏、鳥氨酸氨甲酰基轉移酶缺乏、瓜氨酸血癥1型、精氨琥珀酸尿癥、精氨酸血癥和HHH[高鳥氨酸血癥-高氨血癥-同型瓜氨酸尿癥]綜合征。研究顯示,口服用苯丁酸甘油酯可以維持正常血氨水平、減少高氨危象發(fā)生率、改善患者認知功能和生長發(fā)育水平,并憑借無色無味的口感提升患者服藥體驗,顯著提高患者依從性和生活質量。中國尿素循環(huán)障礙診斷治療和管理指南以1B級推,低蛋白飲食及補充精氨酸和(或)瓜氨酸后仍無法將血氨水平控制在理想范圍的患者,建議選擇氮清除劑苯丁酸甘油酯。
(二)獲批擴大適應癥的罕見病藥物
艾曲泊帕乙醇胺片

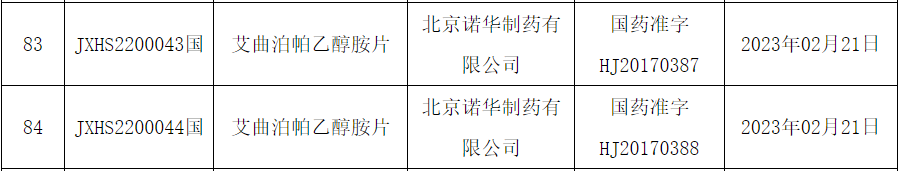
艾曲泊帕(Eltrombopag),又名艾曲波帕,由英國葛蘭素史克(GSK)公司研發(fā),后與瑞士諾華公司合作開發(fā),是全球首個也是唯一一個獲得批準的小分子非肽類TPO受體激動劑。在國內中文商品名為瑞弗蘭,此次獲批用于治療既往對免疫抑制治療緩解不充分的重型再生障礙性貧血(SAA)患者。研究顯示,對于東亞>60歲的重型再障患者,在不少于6個月的艾曲泊帕(75mg qd)治療后,總體有效率可以超過70%,而且在年齡60~70歲的人群中,使用該聯(lián)合方案總體的療效和緩解率與成人總體人群的結果相似。在此之前,其已在中國獲批用于既往對糖皮質激素、免疫球蛋白等治療反應不佳的成人和6歲及以上兒童慢性免疫性(特發(fā)性)血小板減少癥(ITP)患者,使血小板計數(shù)升高并減少或防止出血。
依庫珠單抗注射液


依庫珠單抗(eculizumab)注射液(中文商品名:舒立瑞),是阿斯利康旗下的強勁新藥,在國內外醫(yī)學研究和市場格局上均頗受矚目。該藥最初由Alexion公司開發(fā),是一款“first-in-class”C5補體抑制劑,通過抑制補體級聯(lián)反應終端的C5蛋白,降低炎癥反應。此次依庫珠單抗在國內獲得第三個適應癥,成為當前中國首個獲批用于治療gMG的補體抑制劑。其關鍵III期臨床試驗REGAIN研究結果顯示,與安慰劑組相比,接受依庫珠單抗治療的抗AChR抗體陽性的難治性gMG患者在肌肉力量以及生活質量方面的MG-ADL評分獲得快速且持續(xù)的改善。為期六個月的REGAIN研究顯示出的改善,在超過130周的開放標簽擴展期研究中得到了持續(xù)。
利司撲蘭口服溶液

神經罕見病創(chuàng)新藥物艾滿欣(利司撲蘭口服溶液用散)是一種運動神經元生存基因2(SMN2)mRNA剪接修飾劑,通過雙位點特異性調控SMN2基因(SMN1同源基因)的剪接,促進保留外顯子7,提高功能性SMN蛋白水平。利司撲蘭可穿透血腦屏障,分布于中樞和外周,可提高全身多系統(tǒng)SMN蛋白水平,且保持穩(wěn)定。2021年6月,利司撲蘭在華首次獲批用于治療2月齡及以上脊髓性肌萎縮癥(SMA)患者,開啟了SMA口服治療的新時代。此次獲批將利司撲蘭的適用人群拓展至16日齡及以上的SMA患者。該適應癥拓展主要基于RAINBOWFISH研究中利司撲蘭對癥狀前SMA患兒的療效和安全性中期分析結果。臨床研究證實,對于1型SMA患者,利司撲蘭可幫助患者實現(xiàn)運動里程碑,獲得呼吸和吞咽、進食等功能的持續(xù)改善,為患者帶來更多全身獲益。同時,對于2/3型患者,利司撲蘭可以改善患者運動功能,提高生活獨立性,減輕照護者負擔。
備注:
(1)引用資料(略)為網絡對藥物獲批的新聞報道;
(2)上述藥物整理僅代表本平臺關注到的罕見病類別范疇。
版權聲明
以上內容來自良醫(yī)匯-罕見病新進展,如有建議或疑問,歡迎致電18017449015。
 長按二維碼
長按二維碼關注精彩內容






