非典型溶血性貧血綜合征(aHUS)是一種血栓性微血管病(TMA),由非免疫性微血管病性溶血性貧血(MAHA)、血小板減少癥和急性腎損傷(AKI)三者組成。在美國,年發病率估計為每百萬人中有2例,每百萬名兒童中存在3例。在日本,目前有100-200名患者被診斷為aHUS。
簡介
既往研究中,50%-60%的aHUS患者存在補體基因變異,如補體因子H(CFH)、補體因子I、膜輔助因子蛋白(MCP)、血栓調節蛋白、補體成分C3和補體因子B。在aHUS患者中,TMA的發生是遺傳或自身免疫異常的結果,導致血管內皮的替代補體途徑失調。補體介導的TMA可發生在任何年齡;在有基因異常的患者中,aHUS的外顯率為20%-50%,這說明發病需要有觸發性刺激。
該病兒童的死亡率高于成人(首次aHUS發作后1年的死亡率兒童和成人分別為6.7%、0.8%),血漿置換或血漿輸注(PE/PI)是aHUS的標準治療方式,29%-48%的aHUS兒科患者在治療后3年內進展為終末期腎病(ESRD)或死亡。雖然PE/PI可以穩定血液學結果,但不能顯著改善腎功能。
重組人源化單克隆抗體Eculizumab已經徹底改變aHUS的治療格局。它可以與補體蛋白C5結合,并通過C5轉化酶抑制其裂解。當兒科患者高度懷疑存在aHUS時,專家共識建議在發病后24-48小時內使用Eculizumab作為一線治療。當Eculizumab不可用時,需要使用PE,但建議盡快給予Eculizumab。
在日本,Eculizumab于2013年9月被批準用于aHUS,監管當局授權上市后監測(PMS)以評估Eculizumab在日本aHUS患者中的安全性和有效性。本研究報道了PMS隊列的完整數據集的分析結果。
材料和方法
入組人群為基于2013年9月至2018年1月期間日本aHUS臨床指南診斷aHUS并開始Eculizumab治療的患者。在此期間,日本對aHUS的診斷標準不斷演變,導致了納入標準隨之變化。在2013年的臨床指南中,排除產志賀毒素的大腸桿菌(STEC)溶血性尿毒綜合征和血栓性血小板減少性紫癜(TTP)后,如果存在MAHA、血小板減少和AKI,則診斷為aHUS。血紅蛋白水平<10g/dL提示MAHA,血小板(PLT)計數<150×109/L提示患有血小板減少癥。血清肌酐(sCr)水平≥年齡和性別特異性兒童參考范圍上限的1.5倍,表明兒童存在AKI。如果具有血栓反應蛋白1型基序13(ADAMTS13)活性的分解素樣和金屬蛋白酶活性為≥5%-10%,則排除TTP。
治療
Eculizumab按照獲批的標準劑量依據體重給藥,給藥時間和間隔由醫生確定,間隔大于30天定義為停藥,首次給藥前為患者進行腦膜炎鏈球菌疫苗接種。
安全性和有效性評估
Eculizumab的有效性和安全性評估的定義見表1。根據國際人類使用藥物技術要求協調理事會E2D指南,將嚴重不良事件(SAEs)的嚴重程度分為六類。
統計分析
療效終點的分析是通過患者的數量和比例以及雙側的95%置信區間(CI)來總結的。PLT計數、LDH、sCr和eGFR水平的絕對值和與基線的變化用描述性統計進行總結。生存分析通過Kaplan-Meier分析估計。除體重外,未對缺失數據進行估算。體重為Eculizumab給藥前記錄的最新數據。在安全性分析中,計算了每個事件的患者人數和發生率。在所有的分析中,使用雙側P值(顯著性水平<0.05)。
結果
共72例患者在2013-2015年間診斷aHUS且接受過至少一劑Eculizumab治療,納入PMS中。在排除以下患者后,共對40名兒科患者進行了進一步評估:2例診斷時沒有記錄的患者,3例STECHUS,2例診斷時不符合TMA標準,以及25例根據日本2015年臨床指南的繼發性TMA。
人群基線特征
在基線時,患者的中位年齡為5.0歲(0-17歲);12例(30%)患者年齡小于12個月。20/33例患兒中存在補體基因變異或自身抗體。共34例(85%)患者的PLT計數<150×109/L,33例(83%)患兒LDH>1.5倍ULN。Eculizumab治療的中位時間為66.0周(范圍0-268),77.5%的患者接受Eculizumab治療時間≥26周。
Eculizumab治療aHUS兒科患者的療效
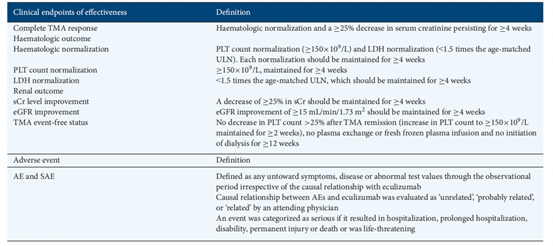
接受Eculizumab治療的患者PLT計數、LDH和eGFR水平的變化情況見圖1,基線時PLT水平的平均值為85.4×109/L[標準差(SD)86.7],在第一次使用Eculizumab后10天增加到270.2×109/L(SD147.5),平均變化為182.9×109/L(SD155.6;P<.001](圖1A)。基線的平均LDH水平為1515.1U/L(SD1236.5),在第一次使用Eculizumab后10天下降到601.5U/L(SD360.4),10天內LDH的平均變化具有統計學意義(P<0.001)(圖1B)。基線的平均eGFR為45.5mL/min/1.73m2(SD34.9),在首次用藥后的10天,eGFR改善到69.5mL/min/1.73m2(SD41.2),平均變化為20.4mL/min/1.73m2(SD31.1;P<0.01)(圖1C)。共有15/19例在基線時接受透析的患者在觀察期結束時停止了透析。共有22/30例患者(73.3%)達到完全的TMA反應。通過Kaplan-Meier分析來估計達到每個療效終點的時間(圖2)。實現療效終點的中位時間為:TMA完全反應21天(95%CI19-91),SCR水平改善14天(95%CI7-21),PLT計數正常化為7天(95%CI為6-7),LDH正常化時間為20天(95%CI為18-27)。
圖1:實驗室指標和腎功能的平均值
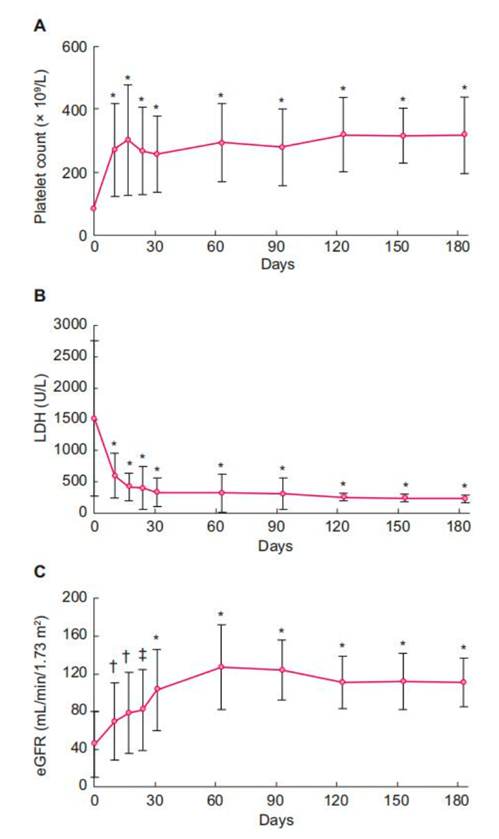
圖2:到達研究終點的時間
停藥患者
總共有18/40例患者符合停藥的標準;4例死亡,也符合標準。在這18例患者中,13例直到觀察結束仍完全退出治療(表4),5例患者延長了治療間隔,但在觀察結束時繼續治療。在13名仍然退出Eculizumab治療的患者中,6名患者的抗CFH抗體陽性(患者1、2、5、8、9和12)。患者5和9在抗CFH抗體水平降低后退出治療,患者12在Eculizumab停用后開始免疫抑制治療。一例患者(7號患者)報告在停用Eculizumab后腎功能出現惡化。
在延長治療間隔的5例患者中,1例復發。該患兒為13歲的男孩,攜帶C3p.Ile1157Thr變異,之前有兩次TMA發作的歷史,并且有aHUS家族史,這是一個已知的復發風險因素。由于去醫院看病困難而停藥,中斷治療120天后復發,于是重新開始治療。
Eculizumab治療aHUS兒科患者的安全性
對于安全分析組中的40名患者,共12名患者報告了29例感染相關的SAE,包括1例腦膜炎球菌血癥。最常見的SAE是腎功能損害(5例,0.06/患者-年)。該隊列的總生存率估計為89.2%,有4例死亡報告,但都與Eculizumab治療無關。
討論
這是日本4.5年來對Eculizumab治療兒科患者aHUS的安全性和有效性的最終分析。這項研究展現了真實世界的附加價值,并進一步證實了Eculizumab對小兒aHUS患者是安全和有效的。
在本研究中,采用了LDH正常化<1.5倍ULN的定義,而非之前中期分析中的小于年齡匹配的ULN。在中期分析中,兒科患者完全TMA反應的比例高于成人患者;但低于Greenbaum等人報告的原始臨床試驗數據。這主要是由于在使用小于年齡匹配的ULN的定義時,LDH正常化的比例較低(分別為48%和82%),該標準對于評估Eculizumab在日本兒科患者真實世界中的有效性來說過于嚴格。使用修改后的LDH正常化定義為<1.5倍ULN,分別有77%和73%的患者觀察到LDH正常化和完全TMA反應,與臨床試驗中類似。本研究中觀察到的早期反應與臨床試驗相似。
一項全球aHUS注冊研究顯示,在6-17歲的兒童患者中,最常見的aHUS病因是CFH抗體。本研究中,18%的患兒存在CFH抗體,而3/13(23%)例6-17歲的患兒的抗體呈陽性。其中4例存在基因變異或缺失導致CFHR蛋白的丟失,這表明遺傳易感性和抗體產生之間存在關系。
本研究中,2/18名患者(11%)出現了腎功能惡化或aHUS復發。這一比例低于既往報導的21%-32%的aHUS復發率,可能是由于該隊列中CFH變異的比例(20%)低于歐洲人群。
在本研究中停止Eculizumab治療的其他患者中,還發現了MCP或C3基因的罕見變異。CFH(31%-55%)、MCP(18%-52%)和C3(50%)中存在的罕見補體基因變異似乎與TMA復發的風險較高有關。既往研究表明,C3p.I1157T是日本人群中最主要的變體。在最近的一份病例報告中,腎臟活檢表明,腎臟不可逆損傷的實質性進展與C3p.Ile1157Thr變體患者的反復TMA有關。
這項研究有一些局限性。首先,由于PMS設計的性質,也可能存在數據缺失、少報或隨訪不完整的情況。其次本隊列中的患者沒有檢測多態性C5p.Arg885His,該基因突變在日本人群的發生率少于3.2%。
總而言之,這個完整的數據集分析進一步證實了真實世界中,Eculizumab對兒科aHUS患者是安全和有效的。
參考文獻:
1.ShuichiIto.HiroshiHataya.et.al.Eculizumabforpaediatricpatientswithatypicalhaemolyticuraemicsyndrome:fulldatasetanalysisofpost-marketingsurveillanceinJapan
版權聲明
以上內容來自良醫匯-罕見病新進展,如有建議或疑問,歡迎致電18017449015。
 長按二維碼
長按二維碼關注精彩內容





